Resolution Algorithms for Discrepant Test Results

Blood screening is critical to help keep the blood supply safe and free of risk factors such as transfusion-transmissible infections. However, safety depends on the accuracy of blood screening results. Since false positives and false negatives do occur, both immunoassay and nucleic acid technology testing (NAT) may be used at the same time to corroborate results. When discrepancies occur between these two testing methods, further testing is required for results resolution. For example, what if immunoassay testing detects an infection but NAT does not? This post will examine the potential scenarios for NAT discrepant results and how to resolve them.
Immunoassays and NAT for Blood Screening
Immunoassay Screening
An immunoassay is a test that uses the specificity of an antigen-antibody reaction to detect the presence and/or determine the concentration of a target molecule, such as antibodies produced in response to infection and antigens.

Nucleic Acid Technology
NAT is highly sensitive and specific for detecting the genetic material of blood-borne viruses such as human immunodeficiency virus (HIV), hepatitis C (HCV), and hepatitis B (HBV). It relies on the amplification of intended target regions of viral nucleic acids for detection. Grifols Procleix Ultrio Elite Assay (used in conjunction with the automated Procleix Panther system) is a qualitative in vitro NAT to screen for HIV-1 and HIV-2 RNA, HCV RNA, and HBV DNA in plasma and serum specimens from individual human donors.
Specimens found to be reactive in the Procleix Ultrio Elite Assay may be run in individual Procleix Ultrio Elite HIV, HCV, and/or HBV Discriminatory Assays to determine if they are reactive for HIV, HCV, HBV, or any combination. The Discriminatory Assay utilizes the same three main steps as the Procleix Ultrio Elite Assay (sample preparation/target capture, transcription-mediated amplification (TMA), and detection), with one difference: it uses HIV-specific, HCV-specific, or HBV-specific probes during detection instead of using the Procleix Ultrio Elite Assay Probe. The Procleix Ultrio Elite HIV Discriminatory Assay does not distinguish between samples that are reactive for HIV-1 and those that are reactive for HIV-2.
What are the Scenarios of Rare Test Results?
- Scenario 1: Sample is immunoassay reactive, NAT non-reactive: A donor's plasma specimen is reactive (ie, signs of infection are present) with an immunoassay for HIV-1, but non-reactive with the Ultrio Elite assay. Does this indicate that there is something wrong with the NAT assay?
- Scenario 2: Sample is immunoassay reactive, NAT non-repeat reactive (ie, not reactive on repeat testing): A donor's plasma specimen is reactive with a serology assay for HIV-1 and reactive with the Ultrio Elite assay. However, the three Ultrio discriminatory tests are all non-reactive. Does this indicate that the Ultrio screening test is a false reactive? Are the discriminatory tests less sensitive than the Ultrio screening test? Or is the immunoassay a false reactive?
- Scenario 3: Sample is immunoassay non-reactive, NAT reactive: A donor's plasma specimen is non-reactive with serology assays but reactive with the Ultrio Elite assay. Does this indicate a false reactive result for the Ultrio assay?
Or the specimen tests are reactive for the discriminatory HCV (dHCV) assay and non-reactive for dHIV and dHBV. The specimen continues to test non-reactive with repeat and alternative serology assays. Does this indicate that serology tests are false non-reactive?

Rare Test Results are Predictable and Explainable
Scenario 1: How can a donor be serology reactive for HIV-1, but NAT non-reactive?
Approximately 0.2 - 0.5% of HIV-1 infected people have viral concentrations in their blood which at times are undetectable even by NAT assays. These individuals are referred to as "Elite Controllers." Their immune system has an antibody response to the infection, but the viral titer is very low. Such individuals may not have any illness that they associate with HIV infection and they feel well enough to donate blood. They may not have experienced symptoms, may not recognize symptoms, or may be untruthful about risky behavior regarding sexually transmitted diseases. It is also possible that an HIV-positive individual who is on antiviral therapy may donate blood.²
Scenario 2: How can a donor be non-repeat reactive for HIV-1, but serology repeat-reactive?
The viral concentration is probably very low in this individual and close to the detection limit of the NAT test; therefore, viral genetic material is sometimes detectable and at other times is undetectable. This could be because:
- The donor is an elite controller (rare) or their immune system is (for now) suppressing the viral concentration
- The donor could be HIV-1 positive and taking antiretroviral drugs and could still donate blood (rare but possible)
- The NAT test is stochastically (randomly) detecting the HIV-1 RNA because of poor test performance (rare but known to happen, eg, probe/primer base pair mismatch)
In these cases, if the donor can be called back for more testing, a higher viral titer may be detected.
Scenario 3: How can a donor be NAT reactive but serology non-reactive?
This is likely an example of a "window period," which is defined as the time between the moment of infection and when the presence of the virus can first be identified in the blood (by detecting antibodies, antigens, DNA, or RNA). All tests have a window period, which varies between test. For example, for HCV the estimated window period is:
- Three days for NAT on individual donations (ID-NAT)
- Five days for mini pool NAT (MP-NAT; ie, donor samples are pooled together in small batches prior to testing)
- Sixty-five days for the detection of anti-HCV antibodies
Thus, HCV infection can be NAT reactive for up to 2 months before the donor is immunoassay reactive, and during this 2-month period, the donor sample would be NAT reactive, but serology non-reactive (ie, scenario 3).
What is the Reason for Discordant (Conflicting) Test Results Between Immunoassays and NAT?
As noted above, conflicting results between immunoassays and NAT can be explained by the window periods of the two tests. For HIV infection, anti-HIV antibodies may not be detected by immunoassay until 15 days after infection, while HIV RNA can be detected by NAT from 10 days after infection, reflecting its superior sensitivity. Owing to the different sensitivities of the two tests, between 10 and 15 days after infection, the donor would be NAT reactive, but serology non-reactive. Conflicting results may also be observed in elite controllers, who would be serology reactive from 15 days after infection but may not be NAT reactive because of the very low viral concentration.
What is the Reason for Non-Repeat Reactive Results in NAT?
NAT is very sensitive; however, like all analytical tests, it has a limit of detection (LOD). LOD is a statistical measurement; it is defined as the lowest concentration or amount of material, target, or analyte that is consistently detectable. The 95% detection rate for a virus is the concentration of virus where the test will give a "reactive" result 95% of the time, and the 50% detection rate for a virus is the concentration of virus where the test will give a "reactive" result 50% of the time.
For NAT, the predicted 95% and 50% detection rates in international units (IU) per mL for each WHO standard target (viral RNA or DNA) are determined using Probit Analysis of statistical sensitivity.
- For HIV-1, the predicted 95% detection rate was 18.0 IU/mL for the Procleix Ultrio Elite Assay and 17.3 IU/mL for the Procleix Ultrio Elite HIV Discriminatory Assay
- For HIV-2, the predicted 95% detection rate was 10.4 IU/mL for the Procleix Ultrio Elite Assay and 9.6 IU/mL for the Procleix Ultrio Elite HIV Discriminatory Assay
- For HCV, the predicted 95% detection rate was 3.0 IU/mL for the Procleix Ultrio Elite Assay and 2.4 IU/mL for the Procleix Ultrio Elite HCV Discriminatory Assay
- For HBV, the predicted 95% detection rate was 4.3 IU/mL for the Procleix Ultrio Elite Assay and 4.5 IU/mL for the Procleix Ultrio Elite HBV Discriminatory Assay
Note, there is no statistical difference between the detection rates of the screening assay and the discriminatory assay.
If the donor has a very low virus concentration, the tested sample may or may not have the virus. In this case, just by chance, the initial test sample may have enough virus for a reactive detection, but the discriminatory test may not have enough virus for a reactive result. Such non-repeat reactive results can be resolved by:
- Requesting a second specimen from the donor ("follow up"). As the infection progresses, the viral concentration may rise to a reproducibly detectable concentration
- Using a test algorithm to determine whether a "true" positive or "true" negative result is possible with the specimen
- Replicate testing of a specimen may reveal low viral concentration
Test Algorithms to Resolve Conflicting Assay Results
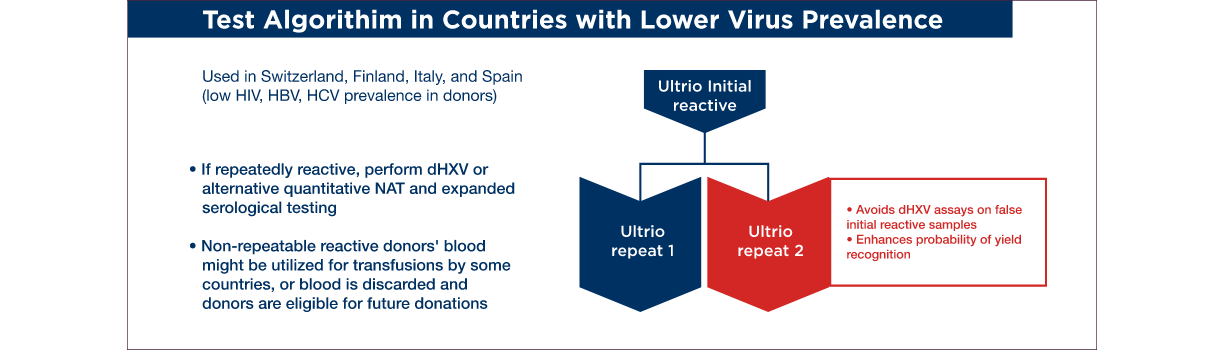
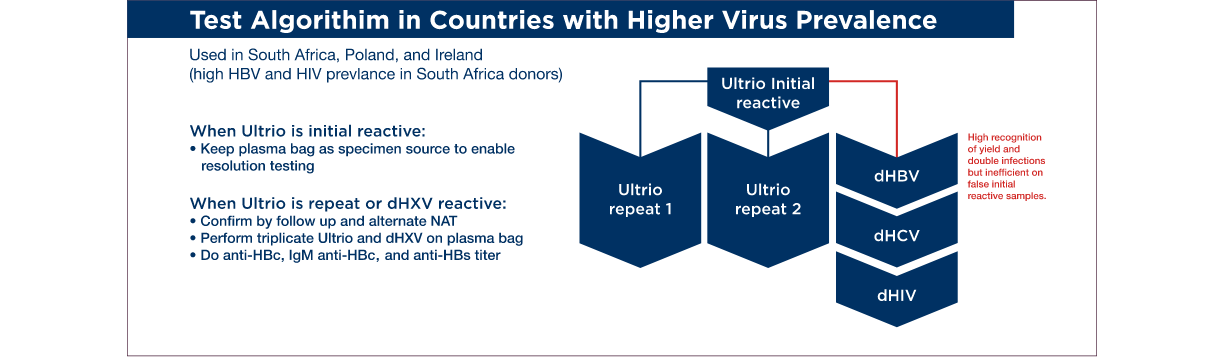
There are many examples of algorithms; here are three examples of algorithms that have been used in different areas of the world. Often the choice of the algorithm is influenced by the prevalence of infection in the donating population in a region. Also, the availability of resources to support repeat testing will influence the extent and complexity of the test resolution algorithm.
References
- Grabarczyk, P. et al (2013) Transfusion 53:2512
- Sykes, W. et al (2019) J. Infec. Dis. 220:643
- Lelie, N. et al (2017) Transfusion 57:24